MEKANISME
REAKSI ELIMINASI E1
Hallo Sobat Chems
Pada blog ini, kita akan membahas mengenai mekanisme reaksi eliminasi E1. Mekanisme reaksi eliminasi E1 berlangsung dengan dua langkah mirip dengan reaksi SN1. Mekanisme reaksi eliminasi E1 dapat kita jabarkan sebagai berikut:
1. Lepasnya gugus pergi yang dibantu dengan katalis asam untuk memprotonasi gugus hidroksil yang kemudian dihasilkan alkohol terprotonasi
2. Gugus H2O+ lepas dan terbentuklah karbokation
3. Basa akan menyerang proton β, yaitu proton yang terikat pada karbon lain yang terdekat dari karbon yang mengikat gugus pergi.
Contohnya bisa dilihat pada
dehidrasi alkohol dengan mekanisme sebagai berikut:
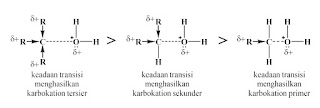
Seperti pada SN1, karbokation pada reaksi E1
mempunyai tingkat kestabilan yang berbeda antara karbokation primer, sekunder
dan tersier. Karbokation primer sangat kurang stabil akibat sedikitnya efek
hiperkonjugasi yang dihasilkan alkil di sekitar muatan positif. Oleh karena
itulah, alkohol primer tidak dapat menjalani reaksi eliminasi dengan mekanisme
E1, tetapi dengan E2.
Ada beberapa petunjuk yang harus kita perhatikan
dalam mekanisme reaksi eliminasi E1 yaitu:
1. Laju
hanya dipengaruhi oleh konsentrasi substrat sehingga jika kita memvariasikan
konsentrasi selain substrat, laju reaksinya tidak akan berubah sama sekali.
2. Jenis
substrat dapat mempengaruhi laju reaksinya, alkil halida tersier lebih cepat
dari alkil halida sekunder dan alkil halida sekunder lebih cepat dari alkil
halida primer.
3. Mekanisme
E1 berjalan dengan hilangnya kelompok yang meninggalkan kemudian terjadi
deprotonasi.
Permasalahan
1.) Pada
reaksi E1, Basa akan memabantu jalannnya reaksi dengan menyerang proton β. Basa
apakah yang digunakan pada reaksi E1 ini dan apakah kekuatan basa akan
mempengaruhi reaksi E1?
2.) Dalam
reaksi E1, apakah kestabilan karbokation akan mempengaruhi jalannya reaksi E1? jika
ya, karbokation yang bagaimanakah yanng cocok digunakan pada reaksi E1 ini?
3.) Mengapa
pada reaksi E1 ini basa akan menyerang
proton β dari karbon tetangga terdekat? Mengapa tidak menyerang yang mengikat
gugus pergi?




saya Lara Prastica, NIM A1C119045, ingin menjawab permasalahan no 3. Karena, Gugus hidroksil bukanlah gugus pergi yang baik. Oleh karena itu, agar dapat terlepas dari substrat, biasanya digunakan katalis asam untuk memprotonasi gugus hidroksil. Tahapan ini berlangsung secara cepat yang menghasilkan alkohol terprotonasi. Gugus H2O+ kemudian lepas sehingga terbentuk karbokation. Proses ini berlangsung secara lambat sehingga menjadi penentu laju reaksi. Basa kemudian menyerang proton tetangga karbokation(H beta). Dalam hal ini, molekul basa dapat berupa molekul alkohol yang lain, air, ataupun basa konjugat dari asam yang digunakan pada awal reaksi. Proses
BalasHapustransfer proton ini berlangsung dengan cepat menghasilkan alkena
Baiklah saya Aufa Hasnita NIM A1C119040 Akan mencoba menjawab permasalahan nomor 2
BalasHapusIya . Semakin stabil karbokationnya, semakin mudah terbentuk, dan semakin mempercepat reaksi E1. Terdapat beberapa anggapan bahwasanya sistem dengan karbokation yang kurang stabil akan bereaksi paling cepat, namun pada dasarnya turunan dari karbokationlah yang menentukan laju reaksi. Karena intermediet karbokation terbentuk selama E1, selalu ada kemungkinan penataan ulang (mis. 1,2-hidrida atau 1,2-alkil bergeser) untuk menghasilkan karbokation yang lebih stabil. Ini biasanya ditunjukkan oleh perubahan posisi alkena atau perubahan kerangka karbon produk bila dibandingkan dengan substart.
Terima kasih swmoga membantu